早川 文彦
【急性白血病発症の分子メカニズム解明と治療薬の探索】
がんはあらゆる病気の中でもっとも死亡率が高く、厚生労働省の人口動態統計において、1981年以降ずっと日本人の死因第1位で、全体の3割を占めます。国民の2人に1人ががんになり、3人に1人ががんで亡くなる時代と言われています(全国健康保険協会のホームページ)。急性白血病は自然経過では非常に進行が早く、発症から2〜3ヶ月で亡くなる方が多い疾患です。有効な治療法がなかった1960年代以前は不治の病と恐れられ、化学療法の有効性が示されるようになってからも、長期間におよび副作用の強い治療と、高い再発率から長らく難知性のがんの代表のように捉えられてきました。しかし一方で採血という形で容易に腫瘍細胞を採取して検体を得ることができるという研究上の利点もあり、病態の分子メカニズムでの解明が最も進み、治療薬の開発が最も進んだがんでもあります。がん研究の最先端であり続けている血液腫瘍学ですが、そのような分野であっても白血病を始めとする造血器悪性腫瘍はまだまだ難知性の疾患で、この疾患により命を失う方は多く、治療は多くの苦痛を伴い改善の余地があります。造血器悪性腫瘍の分子病態を解明し、分子病態に即した治療法開発の需要はますます高まっています。
このような情勢の中、当研究室では造血器悪性腫瘍(主には急性リンパ性白血病:ALL)発祥の分子メカニズム解明と、治療法の開発をテーマとした研究を行っています。早川は平成26年度以降、継続して日本医療開発機構(AMED)が行う革新的がん医療実用化研究事業の研究代表をつとめています。「AYA世代における急性リンパ性白血病の生物学的特性と小児治療法に関する研究」(平成26年度〜平成28年度)、「AYA世代急性リンパ性白血病の小児型治療法及び遺伝子パネル診断による層別化治療に関する研究」(平成29年度〜令和元年度)、「AYA世代及び成人T細胞性急性リンパ性白血病の小児型治療適用における限界年齢と新規バイオマーカー探索に関する研究」(令和2年度〜)。これらの研究事業により、全国的な共同研究で急性リンパ性白血病の新規治療法を開発する臨床研究を実施し、それらの研究を通じて収集した白血病患者の遺伝子検体を用いた大規模な遺伝子解析を進めています。同時に、それらの研究で発見された新規の遺伝子異常(主には融合遺伝子)に関して、それが白血病を発症させるメカニズムを研究しています(研究例1,2)。また、これらに加えて疾患病態に即した独自性のある薬剤スクリーニング方法を開発して、従来の薬剤開発では見逃されてきた抗腫瘍活性を持つ薬剤を、既存の薬剤の中から発見する研究も行っています。
研究例1 急性リンパ性白血病(ALL)の網羅的遺伝子解析

多施設共同の臨床研究で収集した15-24歳ALL73例の検体につき、RNAシークエンス解析を行い、DUX4融合遺伝子(新規発見)、ZNF384融合遺伝子(従来1%程度と報告されていました)、MEF2D融合遺伝子(従来頻度不明でした)が、この年代のB細胞性ALLの18.5%、16.7%、9%という高い頻度で認められることを発見しました(Yasuda T et al., Nature Genetics, 2016(図1)。さらにこれらの遺伝子異常と臨床情報を組み合わせて解析し、DUX4融合遺伝子、ZNF384融合遺伝子陽性の症例には予後良好、MEF2d融合遺伝子陽性の症例には予後不良の傾向があることを明らかにしました(図2)。さらにこれらの融合遺伝子をレトロウイルスを用いてマウスpro B細胞に導入することで、これらの遺伝子がB細胞分化停止を起こした後、ALLを発症することを示しました。この研究は2016年にNature Genetics誌に論文掲載されました(Yasuda T et al., Nat Genet; 48: 569-574, 2016)。
現在は25-64歳のALLの検体を用いて同様の解析を行っています。
研究例2 MEF2D融合遺伝子による白血病発症メカニズムの解明
研究例1で発見したALLの新しい遺伝子異常に関して、これらが何故ALLを引き起こすのかを研究しています。ここでは、MEF2D融合遺伝子に関する研究を紹介します。
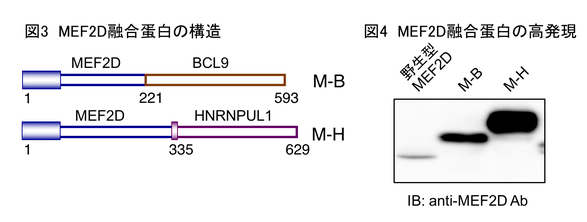
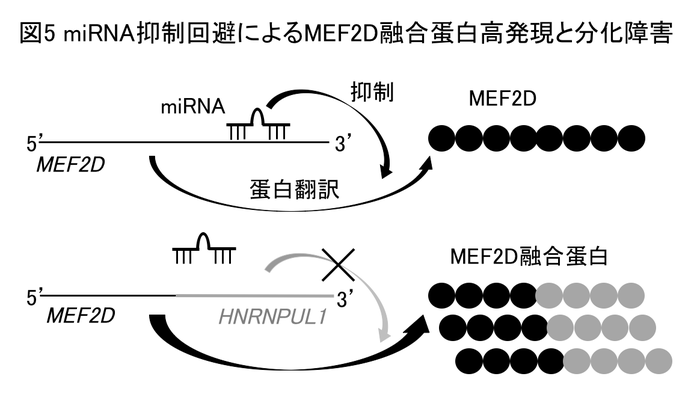
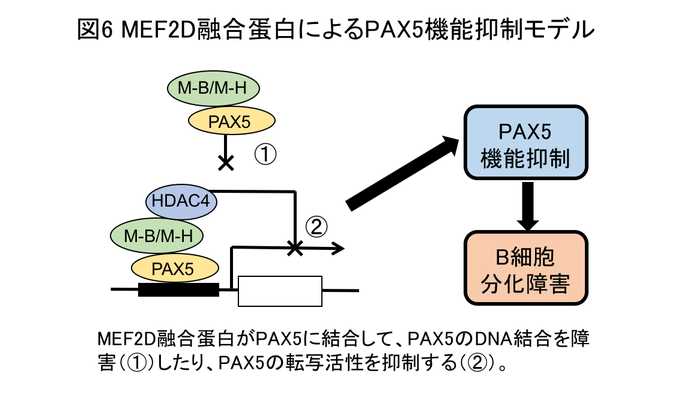
MEF2Dは筋細胞分化を制御する転写因子(他の遺伝子の発現を制御する因子)として知られています。MEF2D融合遺伝子は融合パートナーガ異なるものが複数知られていますが、MEF2D-BCL9(M-B)とMEF2D-HNRNPUL1(M-H)が代表的です。これらは、どちらもMEF2Dの5'側半側とパートナーの3'側半側が融合しており、それによって図3のような融合蛋白が作られます。これらの遺伝子の発現ベクターを作製し細胞の中で蛋白発現させると、MEF2D融合蛋白は野生型より20倍程度高発現していました(図4)。私たちは、この高蛋白発現がMEF2D融合遺伝子がmicro RNAの制御を回避するためであることを発見しました。micro RNAは標的mRNAに結合し、mRNAからの蛋白翻訳を阻害する小さなRNAです。MEF2D融合遺伝子は3'側の遺伝子を転座により失っているため、この部分に結合するmicro RNAによる蛋白翻訳抑制が起こらないために、MEF2D融合蛋白は高発現していることを明らかにしました(図5)。さらにMEF2D融合蛋白が、B細胞分化を制御する転写因子であるPAX5やhistone deacetylase 4(HDAC4:ヒストンを脱アセチル化しmRNAの転写を制御する)と結合することも発見し、これらを総合して、高発現したMEF2D融合蛋白がPAX5の転写活性を抑制することでB細胞分化障害を引き起こし、白血病の原因となるというモデルを提唱しました(図6)。この研究は2019年にOncogene誌に論文掲載されました(Hirano D et al., Oncogene;38:2263,2019)。
〒461-8673
愛知県名古屋市東区大幸南1-1-20
名古屋大学大学院 医学系研究科 総合保健学専攻
細胞遺伝子情報科学講座
東館2F 血液・遺伝子研究室
あなたもジンドゥーで無料ホームページを。 無料新規登録は https://jp.jimdo.com から